婦人科腫瘍研究室
婦人科腫瘍研究室では以下のテーマを中心に研究を進めています。
| 婦人科がん発生機構の分子生物学的解明 | 産婦人科疾患の個別化医療の展開 |
| がん代謝経路を阻害する新規治療法の開発 | 新たな婦人科手術法の開発 |
婦人科がん発生機構の分子生物学的解明
婦人科の3大悪性腫瘍として卵巣がん、子宮内膜がん、子宮頸がんがあげられます。
なかでも卵巣がんは婦人科がんの中で最も死亡率が高く,罹患率も急伸しています.
手術療法,薬物療法が進歩し,5年生存率の改善はみられていますが,10年生存率は30年前からさほど変わっていません.
卵巣は骨盤内臓器であり,進行するまで症状がなく,早期発見が困難で腹腔内播種を伴った進行期で発見されることが多いことが理由と考えられます.
長らくの間,卵巣癌の起源となる細胞は卵巣表層上皮であり,排卵後に形成される封入体嚢胞からの発がん経路が定説と考えられてきました.すなわち,卵巣表層上皮が封入体嚢胞を形成する際にさまざまなgenotoxic stressを受け,卵管上皮,子宮内膜,子宮頸管内膜などのミューラー管を由来とする腺細胞への化生(metaplasia)を生じ発がんに至るという説です.
しかし,21世紀に入り,卵巣癌でも高異型度漿液性腺癌(HGSC)は卵管采の分泌細胞が起源であるとの
「卵管起源説」が唱えられるようになりました.これは卵管采にまず上皮内癌(Serous Tubal Intraepithelial Carcinoma: STIC)
が発生し、これが物理的な接触などにより卵巣表層上皮に移植され、そこで浸潤癌として進展するという仮説です。
すなわち、HGCSのoriginは実は卵巣ではなく、卵管采である、という衝撃的な仮説です。
高異型漿液性癌(HGSC)の卵管采起源説

我々はこの「卵管起源説」を検証する目的で,正常卵管采分泌細胞を培養し、細胞分裂の障壁となる
Rb経路に対してこれを不活化し、さらにテロメレースを活性化させることにより,
不死化卵管采分泌細胞株を樹立しました.
卵管采上皮分泌細胞の不死化細胞株の樹立

この細胞に米国の大規模調査(TCGA:The Cancer Genome Atlas)にて報告されている
HGSCで高頻度に認められる遺伝子異常を導入し、段階的に癌化させた「in vitro 発がんモデル」を構築しました.
この発がんモデルでは,がん化には最低3個の遺伝子異常が必要であり,
マウスに移植した腫瘍ではヒトHGSCに酷似した組織形態が確認されました.
卵管采不死化細胞から漿液性癌を作成

この高異型度漿液性腺癌「in vitro 発がんモデル」をさらに応用し、子宮内膜症上皮細胞を起源細胞とした
低異型度漿液性癌 (Endometriosis-related ovarian neolpasias:ERONs)の「in vtitro 発がんモデル」の構築にも成功しています。
さらに「in vitro 発がんモデル」からの進化モデルとして、婦人科がん由来オルガノイドの構築に成功しており、
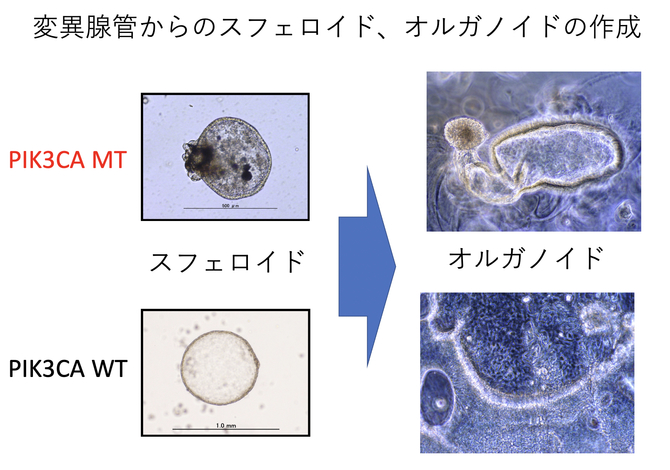
婦人科各種癌のがん幹細胞発癌起源説や婦人科がん個別化医療への応用を目指しています。特に子宮内膜腺管に認められる癌遺伝子変異(ドライバー変異)の機能的意義を明らかにするために、単一腺管(変異有り、無し)からスフェロイド、オルガノイドを作成する画期的な実験系も確立しつつあります。
婦人科組織、がん由来オルガノイドを用いた新たな研究の展開

Selected recent publications (2014~2020)
Katagiri H, Nakayama K, Razia S, Nakamura K, Sato E, Ishibashi T, Ishikawa M, Iida K, Ishikawa N, Otsuki Y, Nakayama S, Kyo S:
Loss of autophagy-related protein Beclin 1 may define poor prognosis in ovarian clear cell carcinomas.
Int J Oncol. 47:2037-2044, 2015.
Nakamura K, Nakayama K, Ishibashi T, Ishikawa N, Ishikawa M, Katagiri H, Minamoto T, Sato E, Sanuki K, Yamashita H, Iida K, Sultana R, Kyo S:
KRAS/BRAF Analysis in Ovarian Low-Grade Serous Carcinoma Having Synchronous All Pathological Precursor Regions.
Int J Mol Sci. 17. E625, 2016.
Nakayama K, Rahman MT, Rahman M, Nakamura K, Ishikawa M, Katagiri H, Sato E, Ishibashi T, Iida K, Ishikawa N, Kyo S:
CCNE1 amplification is associated with aggressive potential in endometrioid endometrial carcinomas.
Int J Oncol. 48:506-516, 2016.
Nakamura K, Nakayama K, Ishikawa N, Ishikawa M, Sultana R, Kiyono T, Kyo S:
Reconstitution of high-grade serous ovarian carcinoma from primary fallopian tube secretary epithelial cells.
Oncotarget 9: 12609-12619, 2017.
Ishikawa M, Nakayama K, Nakamura K, Ono R, Sanuki K, Yamashita H, Ishibashi T, Minamoto T, Iida K, Razia S, Ishikawa N, Kyo S:
Affinity-purified DNA-base mutation profiles of endometriosis-related ovarian neoplasms in Japanese patients.
Oncoratget 9: 14754-1463, 2018.
Pisanic T, Lin SF, Yen TT, Athamanolap P, Nakayama K, Cope L, Wang TH, Shih IM, Wang TL:
Methylomic analysis of ovarian cancers identifies tumor-specific alterations readily detectable in early precursor lesions.
Clin Cancer Res. 24: 6536-6547, 2018.
Ishikawa M, Nakayama K, Nakamura K, Ono R, Yamashita H, Ishibashi T, Minamoto T, Iida K, Razia S, Ishikawa N, Kyo S:
High frequency of POLE mutations in synchronous endometrial and ovarian carcinoma.
Hum Pathol. 85: 92-100, 2019.
Ishibashi T, Nakayama K, Razia S, Ishikawa M, Nakamura K, Yamashita H, Dey P, Iida K, Kurioka H, Nakayama S, Otuski Y, Ishikawa N, Kyo S:
High frequency of PIK3CA mutations in low-grade serous ovarian carcinomas of Japanese patients.
Diagnostics. 10:13,2019.
Ohnishi K, Nakayama K, Ishikawa M, Ishibashi T, Yamashita H, Nakamura K, Minamoto T, Iida K, Razia S, Ishikawa N, Kyo S:
Mucinous borderline ovarian tumors with BRAFV600E mutations may have low risk for progression to invasive carcinomas.
Arch Gynecol Obstet. 302:487-495,2020.
Kyo S, Ishikawa N, Nakamura K, Nakayama K:
The fallopian tube as origin of ovarian cancer: Change of diagnostic and preventive starategies.
Cancer Med. 9: 421-431, 2020.
Kyo S, Sato S, Nakayama K:
Cancer-associated muations in normal human endometrium.
Cancer Sci. 111:3458-3467.2020.
Kyo S, Nakayama K:
Endometrial Cancer as a Metabolic Disease with Dysregulated PI3K signaling: shedding light on novel therapeutic strategies.
Int J Mol Sci. 21: E6073. 2020.
産婦人科疾患の個別化医療の展開
同一疾患であってもバイオマーカーを用いて層別化し、個別化医療が実践されつつあります。
われわれは20年以上に渡る遺伝子解析、タンパク質解析の技術を駆使して、
それぞれの疾病における患者層別化のためのバイオマーカーを多数同定してきました。
本邦でMSI-Hがんに対して免疫チェックポイント阻害薬が保険適用になる前に、
われわれは子宮体癌でMSIが免疫チェックポイント阻害薬のバイオマーカーとなるか検討しました。
MSI-H群とMicrosatellite stable (MSS)群の2群に分け、免疫担当細胞であるCD8や免疫チェックポイント阻害薬の標的である
programmed cell death-1(PD-1)とPD-1 ligand1(PD-L1)の発現を比較しました。
MSI-H群ではMSS群と比較し有意にPD-1、PD-L1、CD8の発現が高い結果となりました。
このことから子宮内膜癌においては、MSI-Hは免疫チェックポイント阻害薬のバイオマーカーであることを
世界で初めて報告しました。
MSIと免疫関連因子の相関


また、脱分化子宮体癌という非常に珍しく予後不良な疾患でも、同様な知見を得ました。
この2つの研究は国際的にも高い評価を受けており、日本産婦人科学会の最高賞であるJSOG Congress Awardを受賞しました。
JSOG Congress Award(2018年)

JSOG Congress Award(2019年)

また、当研究室では京が金沢大学時代から取り組んでいるテロメアbiologyに関する研究も継続しており、
最近では末梢血リンパ球のテロメア長と患者の予後についての検討を進めてきました。
その結果、卵巣癌、子宮頚癌では末梢血リンパ球のテロメア長が短い場合、予後が極めて不良であり、
末梢血リンパ球テロメア長測定があらたな疾患層別化のバイオマーカーとなることを発見しました。
白血球テロメア長と予後

さらに我々は周産期グループと連携して、妊娠、出産と母体、胎児のテロメア長に関するコホートstudyも立ち上げています。
特に臍帯血(すなわち胎児)の白血球のテロメア長に注目し、様々な妊娠関連パラメーターとの相関を見ると、
興味深いことに体外受精などの生殖補助医療(ART)による妊娠で生まれた新生児は、テロメア長が短いという新知見を得ました。
テロメア長の短縮は成人後の生活習慣病発症リスクに影響を及ぼす可能性があり、
ARTによる妊娠は今後も世界的に増加していくと予想されることから、この領域のさらなる研究を検討しています。
臍帯血(胎児)白血球のテロメア長を規定する因子の探索

Selected recent publications (2014~2020)
Nakamura K, Nakayama K, Ishikawa M, Katagiri H, Katagiri A, Ishibashi T, Sato E, Sanuki K, Yamashita H, Komatsu-Fujii T, Kyo S:
High pretreatment plasma D-dimer levels are related to shorter overall survival in endometrial carcinoma.
Eur J Obstet Gynecol Reprod Biol. 201:89-93, 2016
Yamashita H, Nakayama K, Ishikawa M, Nakamura K, Ishibashi T, Sanuki K, Ono R, Sasamori H, Minamoto T, Iida K, Sultana R, Ishikawa N, Kyo S:
Microsatellite instability is a potential biomarker for immune checkpoint inhibitors in endometrial cancer.
Oncotarget 9:5652-5664, 2017.
Nakamura K, Nakayama K, Ishikawa N, Minamoto T, Ishibashi T, Ohnishi K, Yamashita H, Ono R, Sasamori H, Razia S, Hossain MM, Kamrunnahar S, Ishikawa M, Kyo S.
Preoperative tumor size is associated with deep myometrial invasion and lymph node metastases and is a negative prognostic indicator for patients with endometrial carcinoma.
Oncotarget 9:23164-23172, 2018.
Takakura M, Matsumoto T, Nakamura M, Mizumoto Y, Myojyo S, Yamazaki R, Iwadare J, Bono Y, Orisaka S, Obata T, Iizuka T, Kagami K, Nakayama K, Hayakawa H, Sakurai F, Mizuguchi H, Urata Y, Fujiwara T, Kyo S, Sasagawa T, Fujiwara H.
Detection of circulating tumor cells in cervical cancer using a conditionally replicative adenovirus targeting telomerase-positive cells.
Cancer Sci. 2018109:231-240.
Sato E, Nakayama K, Razia S, Nakamura K, Ishikawa M, Minamoto T, Ishibashi T, Yamashita H, Iida K, Kyo S:
ARID1B as a Potential Therapeutic Target for ARID1A-Mutant Ovarian Clear Cell Carcinoma.
Int J Mol Sci. 19. pii: E1710, 2018.
Ono R, Nakayama K, Nakamura K, Yamashita H, Ishibashi T, Ishikawa M, Minamoto T, Razia S, Ishikawa N, Otsuki Y, Nakayama S, Onuma H, Kurioka H, Kyo S:
Dedifferentiated endometrial carcinoma could be a target for immune checkpoint inhibitors (Anti PD-1/PD-L1 Antibodies).
Int J Mol Sci. 20. E3744, 2019.
Ishikawa M, Nakayama K, Nakamura K, Yamashita H, Ishibashi T, Minamoto T, Iida K, Razia S, Ishikawa N, Nakayama S, Otsuki Y, Kyo S:
High PD-1 expression level is associated with an unfavorable prognosis in patients with cervical adenocarcinomas.
Arch Gynecol Obstet. 302: 209-218, 2020.
Shanta K, Nakayama K, Ishikawa M, Ishibashi T, Yamashita H, Sato S, Sasamori H, Sawada K, Kurose S, Mahmud HM, Razia S, Iida K, Ishikawa N, Kyo S:
Prognostic value of peripheral blood lymphocyte length in patients with gynecologic malignant tumors.
Cancers. 12: E1469, 2020.
Nakamura K, Aimono E, Tanishima S, Imai M, Nagatsuma AK, Hayashi H, Yoshimura Y, Nakayama K, Kyo S, Nishihara H:
Olaparib monotherapy for BRIP1-mutated high-grade serous endometrial cancer.
JCO Precis Oncol. 3: 283-290, 2019.
Relationship between Microsatellite Instability, Immune Cells Infiltration, and Expression of Immune Checkpoint Molecules in Ovarian Carcinoma: Immunotherapeutic Strategies for the Future.
Yamashita H, Nakayama K, Ishikawa M, Ishibashi T, Nakamura K, Sawada K, Yoshimura Y, Tatsumi N, Kurose S, Minamoto T, Iida K, Razia S, Ishikawa N, Kyo S.
Int J Mol Sci. 20:5129, 2019.
Nakamura K, Aimono E, Tanishima S, Nagatsuma AK, Hayashi H, Nakayama K, Kyo S, Nishihara H:
Intratumoral genomic heterogeneity may hinder precision medicine strategies in patients with serous ovarian carcinoma.
Diagnostics. 10:200.13, 2020.
Pregnancy by Assisted Reproductive Technology Is Associated with Shorter Telomere Length in Neonates.
Minamoto T, Nakayama K, Ishibashi T, Ishikawa M, Nakamura K, Yamashita H, Shanta K, Mahmud HM, Razia S, Iida K, Sakashita G, Nakamura T, Kanda H, Kyo S.
Int J Mol Sci. 21(24):9688, 2020.
がん代謝経路を阻害する新規治療法の開発
近年、栄養素の代謝経路の異常が癌細胞の特徴の一つとして認識され始めました。
癌細胞の特徴として「Hallmark of cancer」がWeinbergらによって提唱されており、
現行の分子標的薬は、細胞増殖シグナル・アポトーシス回避等のHallmarkをターゲットとしているものが多くみられます。
癌細胞は正常細胞と比べ、強力な細胞増殖シグナルの活性化により細胞分裂・増殖が亢進しています。
これを可能とするため癌細胞は、酸素の有無にかかわらずグルコースを利用した解糖経路の活性化を呈することが知られています。
これはWarburg効果と呼ばれ癌細胞の特徴の一つと考えられており、
解糖系の中間生成物によりヌクレオチド、NADPH 、グリセロール等の強力な合成を可能にしています。
しかし実際の癌を取り巻く微小環境は慢性的なグルコース欠乏状態であり、
その濃度は正常組織と比べ、約10分の1と報告されています。そのような環境下で癌細胞は、
他の栄養素からグルコースを合成する“糖新生経路”を活性化することが近年報告されました。
癌細胞が最も多く利用する栄養素は、アミノ酸の一つであるグルタミンであり、糖新生経路の中心的役割を担う酵素がPEPCK (phosphoenolpyruvate carboxykinase)です。
癌細胞の代謝経路

PEPCKはoxaloacetateからphosphoenolpyruvate を合成する酵素であり、
正常組織では肝臓等の糖新生臓器に限定して発現しています。
これまで大腸がんでPEPCKが高発現を示し、PEPCKが治療標的となりうることが報告されました。
われわれは、Digital Karyotyping法により卵巣癌での新規増幅遺伝子NAC1を同定しました。
NAC1発現陰性細胞株にNAC1遺伝子を安定導入すると、細胞増殖能の亢進を認め、
ヌードマウスにNAC1を安定導入した細胞株を皮下注射すると腫瘍形成を認めました。
これらの結果からNAC1は卵巣がんの発がんに関与することが示唆されました。
機能ドメイン解析の結果、NAC1タンパク質は、N末端にBTB領域を有しており、
この領域を介して二量体形成することを明らかにしました。
NAC1タンパク質のC末端には、コンピュータ検索により最近同定されたBEN領域を有しており、
試験管内結合実験により、BEN領域を介して直接DNAと結合することを証明しました。
PCRを利用したランダムオリゴDNA結合スクリーニング法により、
BEN領域依存的にNAC1タンパク質に結合するDNA配列も決定しています。
これらの解析から、NAC1に制御を受ける下流遺伝子としてPEPCKを同定しました。
これらのことから、未だ明らかにされていない癌細胞におけるPEPCKの発現機構の一つとして、
NAC1による制御が示唆されます。NAC1によるPEPCK発現制御を中心とした糖新生経路を活性化する代謝制御機構を明らかにし、
NAC1-PEPCKをターゲットとした卵巣がんの新規治療法開発の基盤を構築していきます。
Selected recent publications (2014~2020)
Nakayama N, Kato H, Sakashita G, Nariai Y, Nakayama K, Kyo S, Urano T:
Protein complex formation and intranuclear dynamics of NAC1 in cancer cells.
Arch Biochem Biophys. 606:10-15, 2016
Nakayama K, Rahman M, Rahman MT, Nakamura K, Sato E, Katagiri H, Ishibashi T, Ishikawa M, Iida K, Razia S, Ishikawa N, Kyo S:
NAC1/Gadd45GIP1 axis is related to cisplatin resistance through cellular senescence in ovarian cancer.
Oncol Lett. 6: 4713-4719, 2017.
Nakayama N, Sakashita G, Nariai Y, Kato H, Sinmyozu K, Nakayama J, Kyo S, Urano K, Nakayama K:
Cancer-relate transcription regulatpr protein NAC1 forms aprotein complex with CARM1 for ovarian cancer progression.
Oncotarget 9:28408-28420, 2018
Nakayama N, Higashiguchi T, Hanada K, Maniwa A, Kanemoto Y, Sugiura H, Hara Y, Nakayama K:
Implementation of intravenous drip infusion therapy with peripheral venous catheters and the incidence of related complications in home-based medical care settings in Japan.
Ann Nutr Metab. 73:100-105, 2018.
Nakayama N, Nakayama K, Nakamura K, Razia S, Kyo S:
Sarcopenic factors may have no impact on outcomes in ovarian cancer patients.
Diagnostics 28: 206, 2019.
Prevalence and Associated Factors of Malnutrition and Sarcopenia in a Daycare Facility: A Cross-Sectional Study.
Shiota A, Nakayama N, Saito Y, Maeda T, Maeda Y, Nakayama K.
Healthcare (Basel). 8:576, 2020.
Nucleus Accumbens-Associated Protein 1 Binds DNA Directly through the BEN Domain in a Sequence-Specific Manner.
Nakayama N, Sakashita G, Nagata T, Kobayashi N, Yoshida H, Park SY, Nariai Y, Kato H, Obayashi E, Nakayama K, Kyo S, Urano T.
Biomedicines 8:608, 2020.
新たな婦人科手術法の開発
近年、子宮頸癌の若年化のため、妊孕性を温存する広汎子宮頸部摘出術の必要性が高まっています。
このような背景の中で、我々は妊孕性温存を目指した新しい術式の開発に取り組んでいます。
特に子宮を取らない子宮頸癌手術として開発されてきた広汎子宮的部摘出術(トラケレクトミー)においては、
妊娠率の低さが問題とされてきました。これには様々な因子が関与していると推定されますが、
我々はこの手術で切除される自律神経子宮枝に着目しました。この神経の役割はよくわかっていないのですが、
ラットの実験ではこの神経が子宮収縮の抑制や胎児に対する免疫寛容に寄与していることがわかっており、
この神経を温存することが出来れば妊娠率の向上につながるのではないかと考えました。
慎重に準備を進め、金沢大学の藤原教授との共同で、世界で初めて自律神経子宮枝温存広汎子宮頸部摘出術を導入し、
報告致しました。
妊娠率向上に向けた新たな術式の開発

Eur J Obstet Gynecol Reprod Biol. 193:5-9, 2015
この手術においては、現在では腹腔鏡下手術が可能となり、より低侵襲に行う事が可能となりました。
これまでに再発例はなく、既に妊娠後、帝王切開術での分娩例も経験しております。
この他、子宮頚癌に対する自律神経温存腹腔鏡下広汎子宮全摘術、子宮体癌に対する腹腔鏡下準広汎子宮全摘術の
治療成績等も随時、国際雑誌に公表しています。
また、婦人科低侵襲手術における、新たな術式開発として、bidirectional Stratafix ®を用いた
腹腔鏡下子宮筋腫核出術の確立や、細径ポートを駆使したReduced port surgery、
子宮重量が2kg以上の巨大子宮筋腫に対する全腹腔鏡下子宮全摘術(TLH)、
巨大子宮頸部筋腫に対するTLH、高度癒着症例に対する逆行性TLH(https://www.ess.jjkkpro.jp/)等を開発しております。
高度癒着例のTLHの安全な手技の確立

Clin Exp Obstet Gynecol. 46: 565-569, 2019.
子宮全摘術に代わる、新たな治療法として開発されたマイクロ波子宮内膜アブレーション
(Microwave endometrial ablation、以下、MEA)に関しては本邦での導入の頃から関わり、
ガイドラインの作成から先進医療の導入にも貢献しました。
MEAは体にメスを入れる事なく、経腟的に子宮内膜をマイクロ波で壊死させる方法であり極めて低侵襲です。
本邦でも最多の手術実績誇り、単一施設の短期、長期治療成績を国際雑誌に公表しています。
MEA 施行要因別の再発率の解析

Oncol Lett. 14: 7783-7790, 2017
また、経腟的な筋腫切除術の際の術中大量子宮出血、更年期の大量子宮出血に対する、
緊急止血デバイスとしてのMEAの有効性を世界で初めて発表しました。
この知見は日本産科婦人科学会の主宰する産婦人科診療ガイドラインにも引用され、
今後、大量子宮出血に対するMEAの使用が期待されています。
Selected recent publications (2014~2020)
Kyo S, Mizumoto Y, Takakura M, Nakamura M, Sato E, Katagiri H, Ishikawa M, Nakayama K, Fujiwara H:
Nerve-sparing abdominal radical trachelectomy: a novel concept to preserve uterine branches of pelvic nerves.
Eur J Obstet Gynecol Reprod Biol. 193:5-9, 2015.
Kyo S. Kato T, Nakayama K:
Current concepts and practical techniques of nerve-sparing laparoscopic radical hysterectomy.
Eur J Obstet Gynecol Reprod Biol. 207:80-88, 2016.
Nakamura K, Nakayama K, Ishikawa M, Katagiri H, Katagiri A, Ishibashi T, Sato E, Asakawa Y, Kyo S:
Efficacy of multiple microwave endometrial ablation technique for menorrhagia resulting from adenomyosis.
J Obstet Gynaecol Res. 11:1769-1772, 2015.
Nakamura K, Nakayama K, Ishikawa M, Katagiri H, Ishibashi T, Sato E, Amano C, Kyo S:
Efficacy of microwave ablation for endometrial carcinoma: a single center experience of 3 patients.
Oncol Lett. 11:3025-3027, 2016.
Nakayama K, Tsukao M, Ishikawa M, Ishibashi T, Nakamura K, Sanuki K, Yamashita H, Ono R, Minamoto T, Kyo S:
Total laparoscopic hysterectomy for large uterine cervical myoma.
Mol Clin Oncol. 5:655-660, 2017.
Nakamura K, Nakayama K, Sanuki K, Minamoto T, Ishibashi T, Sato E, Yamashita H, Ishikawa M, Kyo S:
Long-term outcomes of microwave endometrial ablation for treatment of menorrhagia: a retrospective cohort study.
Oncol Lett. 14: 7783-7790, 2017.
Nakayama K, Nakamura K, Ishikawa M, Kyo S:
Microwave endometrial ablation at a frequency of 2.45 GHz for menorrhagia: Analysis of efficacy, recurrence rate and complications of MEA.
Clin Exp Obstet Gynecol. 44:695-699, 2017.
Nakamura K, Nakayama K, Ishikawa M, Katagiri A, Katagiri H, Ishibashi T, Sato E, Kyo S:
GnRH agonist pretreatment for microwave endometrial ablation in women with less than 1 cm myometrial thickness.
J Obstet Gynaecol. 21:1-3, 2018.
Nakamura K, Nakayama K, Minamoto T, Ishibashi T, Sanuki K, Yamashita H, Ono R,
Sasamori H, Sultana R, Hossain M. M., Kamrunnahar S, Ishikawa M, Kyo S:
A novel retrograde approach for total laparoscopic hysterectomy in patients with severe adhesion in the cul-de-sac.
Clin Exp Obstet Gynecol. 46: 565-569, 2019.
Nakayama K, Sultana R, Ishibashi T, Ishikawa M, Yamashita H, Nakamura K, Sawada K, Yoshimura Y, Tatsumi N, Kurose S, Minamoto T, Iida K, Ishikawa N, Kyo S:
Pathological findings in the endometrium after microwave endometrial ablation.
Sci Rep. 10, 20766, 2020.
Yoshimura H, Nakayama K, Sawada K, Yamashita H, Nakamura K, Ishibashi T,
Ishikawa M, Sulutana R, Sato S, Kyo S:
A case of rectal injury due to vaginal pipe misinsertion during total laparoscopic hysterectomy.
Clin Exp Obstet Gynecol. in press.
Ishikawa H, Nakayama K, Yamashita H, Ishibashi T, Sato S, Sasamori H, Sawada K, Kurose S, Sultana R, Ishikawa H, Suehiro S, Kyo S: External iliac artery injury and thrombosis during laparoscopic gynecologic surgery: A case report.
Case Reports in Obstetrics and Gynecology. in press






















